热门关键词: 细胞培养 恒温摇床 移液器使用规范 江苏恒温振荡培养箱报价 生物反应器
人肠道类器官作为一种在体外高度模拟人体肠道结构和功能的三维模型,在疾病建模、药物筛选、宿主-微生物互作及再生医学等领域展现出巨大潜力。其成功构建的基石在于能否高效、稳定地从肠道组织中分离出具有干性的隐窝基干细胞。本文系统性地总结人肠道类器官构建过程中,从组织获取到干细胞分离、最终形成类器官的关键技术要点、常见问题及解决方案,为相关研究提供实践参考。
肠道上皮是一个持续更新的动态系统,其再生能力源于位于肠隐窝基底部的Lgr5+肠道干细胞。2009年,Clevers团队开创性地在体外利用单个Lgr5+干细胞成功培育出具有隐窝-绒毛结构的肠道类器官,标志着该领域的重大突破。这一技术的核心在于:从人肠道组织中分离出完整的隐窝单元或活性干细胞,并将其置于能模拟体内干细胞巢(Niche)的基质胶中,提供必需的生长因子信号。
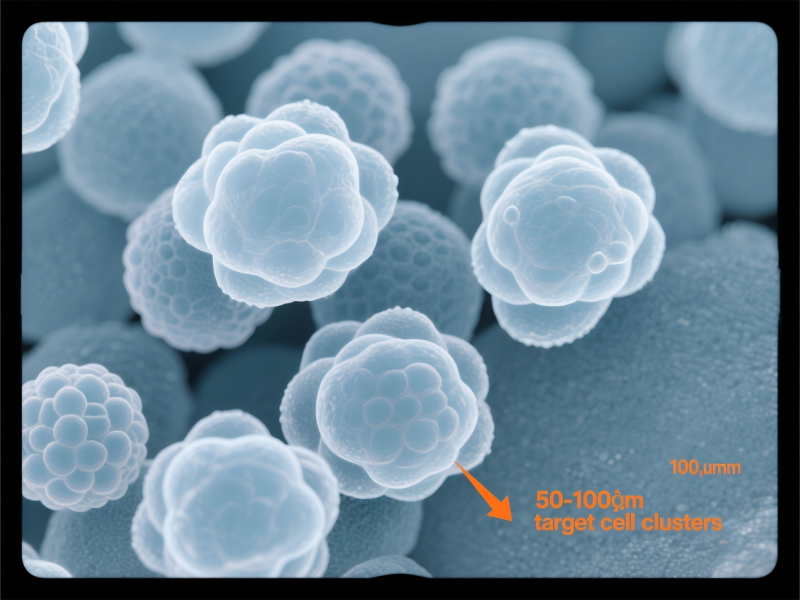
整个流程可大致分为:组织前处理、隐窝/干细胞分离、类器官培养与传代。每一步的精细操作都直接影响最终的成败。
技术要点:
样本来源与运输: 样本可来源于手术切除的健康或病变肠段、内镜活检组织。关键在于保持组织活性。离体后应立即置于预冷的(4°C)组织保存液(如含有高浓度抗生素的Advanced DMEM/F12)中,并在最短时间内(建议<24小时)进行处理。冰上操作以降低代谢。
组织清洗与修剪: 用含有多重抗生素(如青霉素/链霉素、庆大霉素、两性霉素B等)的PBS或Advanced DMEM/F12充分冲洗,直至清洗液清澈,以去除黏液和内容物。随后,使用精细解剖工具小心去除肠壁的肌肉层和脂肪组织,仅保留黏膜层。这一步能极大减少后续的微生物污染和成纤维细胞过度生长。
黏膜剥离: 将修剪后的黏膜组织剪成约0.5 cm²的小块,便于后续消化。
这是整个流程中最关键、技术性最强的环节,主要方法有化学消化法和物理分离法。
A. 化学消化法(最常用)
原理: 利用螯合剂和酶选择性解离细胞间连接,释放隐窝结构。
关键试剂: EDTA (乙二胺四乙酸) 是核心。它通过螯合Ca²⁺和Mg²⁺,破坏依赖于二价阳离子的细胞黏附分子(如E-cadherin),从而松解隐窝单元。
标准流程与要点:
EDTA孵育: 将组织碎片置于含2-30 mM EDTA的PBS溶液中(常用浓度为5-10 mM),在4°C下缓慢摇动孵育30分钟至2小时。低温孵育有助于温和解离,减少对干细胞的损伤。
机械震荡: 孵育后,用力摇晃试管或使用大口径吸管反复吹打。此时,隐窝应从黏膜上脱落,悬液变得浑浊。
洗涤与收集: 使用预冷的PBS或基础培养基洗涤细胞悬液,通过100 μm细胞筛过滤以去除大块组织。滤液需再次通过40 μm细胞筛,此时完整的隐窝(通常>40 μm)会被截留在筛网上,而单个细胞和碎片则被滤除。
显微镜下确认: 收集40 μm筛网上的物质,重悬后于倒置显微镜下观察。成功的分离应看到大量形态完整、呈“花瓶状”或“戒指状”的隐窝结构,轮廓清晰,内部细胞紧密。碎片和单个细胞应尽可能少。
B. 隐窝富集与纯化
目的: 进一步提高隐窝的纯度,去除残留的单个细胞(多为分化的上皮细胞或免疫细胞)和死细胞。
技术:
自然沉降法: 利用隐窝与单个细胞沉降速度的差异,将细胞悬液静置于冰上5-10分钟,小心吸取上清(含较多单个细胞和碎片),重复2-3次。
密度梯度离心法: 使用如Percoll等密度梯度离心介质,可以更精细地分离出高纯度的隐窝。
技术要点:
基质胶包埋: 将收集到的隐窝与预冷的基质胶(如Matrigel®或Cultrex BME)充分重悬。关键:所有操作必须在冰上进行,以防止基质胶提前聚合。
以每滴20-50 μL的体积将胶滴加至培养板孔中,随后在37°C下孵育15-30分钟,使其完全固化。
类器官培养基: 在固化的基质胶上覆盖富含生长因子的类器官培养基。核心生长因子组合包括:
Wnt3a: 维持干细胞自我更新的关键信号。
R-spondin 1: 增强Wnt信号通路。
Noggin: BMP信号通路抑制剂,促进隐窝形态发生。
EGF: 刺激上皮细胞增殖。
此外,还需添加B27、N2等补充剂,以及如Gastrin、Nicotinamide等小分子。
培养环境: 置于37°C、5% CO₂的恒温培养箱中。培养基需每2-3天更换一次,以保持生长因子活性和营养供给。
当类器官生长至中心区域变暗、充满细胞时(通常培养后5-10天),需要进行传代。
消化: 使用机械吹打或温和的消化酶(如Accutase、TrypLE)将类器官和基质胶消化成单个细胞或小的细胞团块。
重悬与再铺板: 将消化后的细胞悬液按适当比例(通常1:3至1:6)与新的基质胶混合,开始新一轮的培养。
| 常见问题 | 可能原因 | 优化策略 |
|---|---|---|
| 类器官无法形成或生长缓慢 | 干细胞活性差、生长因子失效/浓度不足、EDTA过度消化 | 确保组织新鲜;分装并妥善保存生长因子,使用前检测活性;优化EDTA浓度和孵育时间。 |
| 类器官中大量出现死亡细胞 | 消化过度、微生物污染、培养基渗透压或pH不当 | 缩短消化时间,使用更温和的消化酶;加强抗生素/抗真菌剂使用;确保培养基配制准确。 |
| 类器官形态异常(如囊肿化) | Wnt信号过强或失衡、基质胶批次差异、消化过度 | 适当降低Wnt3a浓度;尝试不同批次的基质胶;优化传代时的消化程度。 |
| 成纤维细胞污染 | 黏膜层修剪不彻底、分离过程中混杂 | 更精细地解剖,彻底去除黏膜下组织;利用成纤维细胞贴壁更快的特性,通过差速贴壁法去除。 |
| 类器官分化能力不足 | 持续高水平的干细胞因子抑制了分化 | 在培养基中撤除Wnt3a和R-spondin,或添加分化诱导因子(如Notch抑制剂DAPT),进行分化培养。 |
高效分离具有完整功能的人肠道干细胞是成功构建类器官的前提。掌握从组织处理、EDTA温和消化到隐窝纯化等一系列关键技术细节,是获得高活性、高纯度干细胞群的决定性因素。随着技术的不断进步,如利用流式细胞术或特定的实验室仪器分选特定标志物(如CD24, CD44)的干细胞亚群,或通过非整合性重编程手段获得诱导性多能干细胞来源的肠道类器官,将进一步拓宽该技术的应用边界。对技术要点的深刻理解和不断优化,将是推动人肠道类器官技术在基础研究与科研应用中发挥更大价值的关键。
苏州阿尔法生物实验器材有限公司成立于2008年,位于苏州园区生物纳米园(Biobay)A5幢301室。公司管理团队专注于科学仪器行业十四年,拥有专业的技术团队与完善的售后服务体系,目前已为300余家实验室提供优质产品和服务,涵盖各大高校、检测中心、科研机构、制药企业等13个群体。提供的实验室仪器主要包括振荡培养箱,恒温恒湿培养箱、二氧化碳培养箱、生化培养箱、霉菌培养箱、PCR仪,瑞宁移液器,生物反应器,发酵罐,超低温冰箱,液氮罐,高压灭菌器,超纯水机,天平,离心机,离心浓缩仪、研磨机、葡萄糖乳酸分析仪等。厂商企业授权包括知楚仪器、朗基、中科美菱,梅特勒,乐枫,搏旅、NEST、天根、奥盛在内的80个余厂家。



咨询热线
0512-62956104