热门关键词: 细胞培养 恒温摇床 移液器使用规范 江苏恒温振荡培养箱报价 生物反应器
作为每天要帮实验室客户解决各种 Transwell 问题的实验耗材供应商,我见过太多同学因为操作细节没把控好,明明细胞状态没问题,最后却得不到能用的数据 —— 要么膜上细胞太少,要么下室细胞污染,甚至连 Transwell 小室怎么放都能搞错。

其实细胞迁移实验本身不复杂,但90% 的失败都藏在 “不起眼” 的细节里。今天就从 “耗材准备 - 细胞处理 - 实验操作 - 结果统计” 全流程,把我总结的实操要点和避坑经验分享给大家,新手照着做,基本能一次出有效数据。
一、实验前:耗材和试剂准备,这些 “预处理” 别省
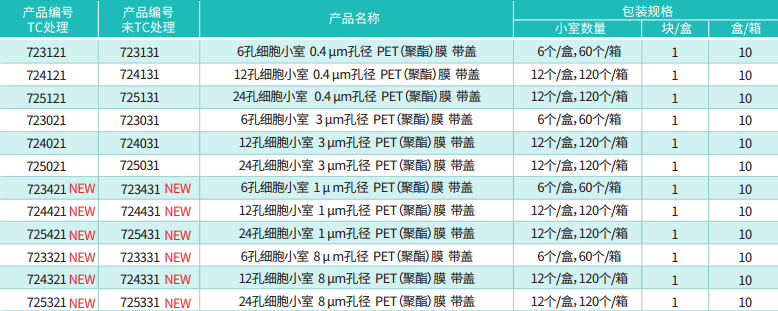
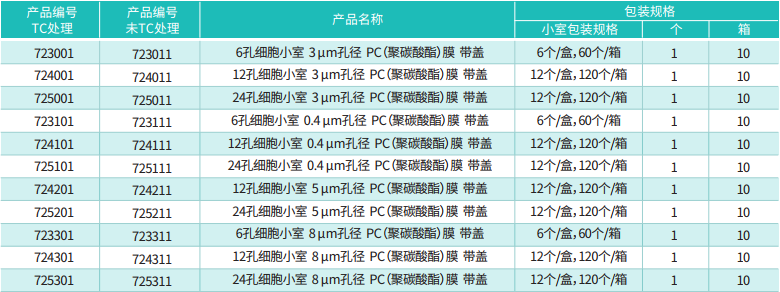
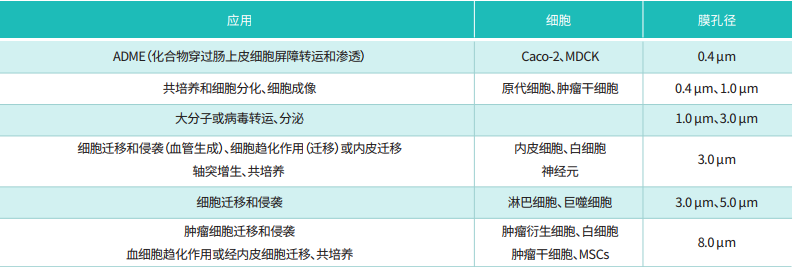
很多人拿到 Transwell 小室就直接用,其实第一步 “预处理” 没做好,后续再努力也白费。先明确:我们常用的 Transwell 小室(迁移实验用无基质胶的,侵袭实验才加 Matrigel),核心是聚碳酸酯膜(孔径一般选 8μm,除非细胞特别大 / 小,比如神经元可能用 12μm),实验耗材膜的处理和试剂配比是关键。
1. Transwell 小室的预处理:别让 “气泡” 毁了实验
• 第一步:激活膜的亲水性
新的小室膜是疏水的,细胞没法附着迁移,必须先用水或培养基浸润激活。操作时用无菌枪头吸取无血清培养基(或 PBS),缓慢加到小室内部(膜上方),注意别戳到膜!加完后放在培养板孔里,室温静置 20-30 分钟,让膜充分吸水变亲水。
✅ 避坑:别用血清培养基激活!血清里的蛋白会提前吸附在膜上,反而影响细胞迁移。
• 第二步:去除膜上残留液体
激活后,用无菌吸头轻轻吸掉小室内部的培养基(动作要轻,别把膜吸破),再把小室倒扣在无菌滤纸上吸 10 秒,把膜上多余的液体吸干 —— 残留液体太多,会导致上室细胞悬液被稀释,影响细胞密度。
2. 试剂配比:血清浓度是 “迁移动力”,别乱加
Transwell 迁移的原理是 “趋化作用”:下室的血清(营养)吸引上室的细胞穿过膜,所以上下室的血清浓度差是关键,配比错了细胞根本不迁移。
• 上室:无血清培养基(或含 0.1%-0.5% 血清,避免细胞饥饿过度,但浓度绝对不能高于下室)
• 下室:含 10%-20% 血清的培养基(根据细胞类型调整,比如肿瘤细胞用 10% 足够,成纤维细胞可能需要 20%)
⚠️ 重点:下室加培养基时,要先加到培养板孔里,再放入预处理好的小室,避免小室下方产生气泡 —— 气泡会顶住膜,细胞穿不过去,最后下室没细胞,白做!
二、细胞处理:状态比数量更重要,这 3 步别错
很多同学纠结 “上室加多少细胞”,其实比数量更重要的是细胞状态—— passages 太多、有污染、贴壁不牢的细胞,迁移能力会差很多,数据根本不可信。
1. 细胞消化:别消化过度,避免损伤细胞膜
• 用胰酶消化时,看到细胞边缘收缩、轻轻吹打能散开就停,立刻加含血清的培养基终止消化(血清能中和胰酶)
• 别用枪头猛吹,避免细胞破裂 —— 破裂的细胞会沉在膜上,最后计数时会算成 “迁移细胞”,导致数据偏高。
2. 细胞计数:调整浓度,保证膜上细胞均匀
• 消化后的细胞离心(1000rpm,5 分钟),弃上清,用无血清培养基重悬(和上室培养基一致),吹成单细胞悬液
• 计数后调整浓度:一般上室加 2-5×10⁴个细胞 / 孔(24 孔板),具体看细胞大小 —— 比如 A549 细胞小,加 5×10⁴;HCT116 细胞大,加 2×10⁴。
✅ 技巧:如果不确定浓度,先做预实验(比如设 2、4、6×10⁴三个梯度),选 “24 小时后膜上还有少量未迁移细胞,下室有明显迁移细胞” 的浓度。
3. 上室加样:别让细胞堆积在中间
• 加细胞悬液时,枪头贴着小室内壁缓慢加(别直接滴在膜上),加完后轻轻晃一下小室,让细胞均匀分布在膜上
• 上室液体体积:24 孔板的小室,一般加 200μL(别加满,留一点空间,避免液体溢出到下室)
• 加完后把培养板放进孵箱,前 30 分钟别碰—— 让细胞先贴在膜上,避免移动导致细胞聚堆。
三、孵育和染色:时间别乱定,染色步骤要 “轻”
孵育时间和染色方法,直接影响最后能不能清晰计数,新手常在这里踩坑。
1. 孵育时间:根据细胞类型定,别盲目跟文献
• 大多数肿瘤细胞(如乳腺癌、肺癌细胞)孵育 24 小时足够;成纤维细胞迁移快,12-16 小时就够;内皮细胞慢,可能需要 36 小时
• 怎么判断时间到了?可以在孵箱里观察:用显微镜看小室膜下方,有明显细胞附着就可以终止,别孵育太久 —— 否则下室细胞太多,会重叠在一起,没法计数。
2. 固定和染色:别把膜弄破,别漏染
• 第一步:弃液
取出小室,先倒掉上室的培养基,再用 PBS 轻轻洗 2 次(别用劲冲,避免把膜上的细胞冲掉)
• 第二步:固定
用 4% 多聚甲醛(PFA)加满上室,室温固定 20 分钟(固定是为了让细胞贴在膜上,后续染色不会掉)
• 第三步:染色
弃掉 PFA,用 PBS 洗 2 次,然后加 0.1% 结晶紫染液(过滤后用,避免有杂质),室温染 15-20 分钟 —— 结晶紫是细胞核染色,颜色深,计数清晰。
✅ 避坑:染色后一定要用 PBS 轻轻洗去多余染液,直到洗出的水变清 —— 否则背景颜色太深,细胞和膜分不清。
3. 擦去上室未迁移细胞:这步是 “数据准确” 的关键
• 染色后,用无菌棉签(或细胞刮子)轻轻擦去小室上表面的细胞(这些是没迁移过去的),擦的时候要顺着一个方向,别来回蹭 —— 避免把膜擦破,或者把下表面的迁移细胞擦掉。
• 擦完后可以在显微镜下看一眼:上表面没残留细胞,下表面有紫色的细胞,就说明擦干净了。
四、结果统计:别只数 1 个视野,这样才客观
很多人随便找个视野数细胞,最后数据波动大,审稿人根本不认可。正确的统计方法,要保证 “随机性” 和 “重复性”。
1. 拍照:选 5 个固定视野,避免主观选择
• 这个步骤一般用不到那种精密的实验室仪器,我们把小室放在生物显微镜下,用 10× 物镜(视野大,计数方便),拍上、下、左、右、中 5 个视野(每个视野间距尽量一致),别只拍细胞多的地方 —— 否则数据偏高,不客观。
• 拍照时保持曝光一致:同一个实验的所有样本,曝光时间、焦距都要一样,避免后续分析时因亮度不同导致计数误差。
2. 计数:手动计数 + 软件分析,双重验证
• 手动计数:用 ImageJ 软件打开图片,用 “Cell Counter” 插件,逐个视野数细胞(紫色的细胞核都算),5 个视野取平均值
• 软件分析:如果样本多,可以用 ImageJ 的 “Threshold” 功能,设置合适的阈值(把细胞和背景分开),然后用 “Analyze Particles” 自动计数,最后和手动计数对比,误差在 10% 以内就可以用。
⚠️ 注意:如果细胞重叠太多(比如孵育时间太长),自动计数会不准,必须手动计数,或者在染色前用胰酶把下室的细胞消化下来,用流式细胞仪计数(更准确,但步骤多)。
3. 重复实验:至少 3 次独立重复,别偷懒
• 单个样本做 3 个复孔(比如对照组 3 孔,处理组 3 孔),然后至少做 3 次独立实验(不同天做),最后用 “平均值 ± 标准差(SD)” 表示数据,用 t 检验或 ANOVA 做统计分析 —— 这样数据才有统计学意义,审稿人才会认可。
五、常见问题排查:做不出数据?先看这 5 点
最后总结几个客户常问的问题,帮大家快速定位问题所在:
|
问题现象 |
可能原因 |
解决办法 |
|
下室几乎没有细胞 |
1. 小室下方有气泡;2. 上下室血清浓度差反了 |
1. 下室先加培养基,再放小室;2. 确认上室无血清,下室有血清 |
|
上室细胞全没了 |
1. 擦细胞时太用力;2. 固定时间不够 |
1. 用棉签轻轻擦,别蹭膜;2. 多聚甲醛固定至少 20 分钟 |
|
细胞重叠严重,没法计数 |
1. 上室细胞加太多;2. 孵育时间太长 |
1. 减少细胞浓度(比如从 5×10⁴降到 2×10⁴); 2. 缩短孵育时间 |
|
背景颜色深,细胞看不清 |
1. 结晶紫没过滤;2. 染色后没洗干净 |
1. 染液用 0.22μm 滤膜过滤;2. 用 PBS 多洗几次,直到水变清 |
|
不同复孔数据差异大 |
1. 细胞悬液没吹匀;2. 加样时细胞聚堆 |
1. 重悬细胞时多吹几次,保证单细胞悬液;2. 加样后轻轻晃小室 |
其实 Transwell 迁移实验,只要把 “膜的预处理、血清浓度差、细胞状态、计数方法” 这几个关键点把控好,就能稳出数据。如果还有其他问题,比如不知道选哪种孔径的小室,或者需要匹配特定细胞的实验耗材,也可以进入苏州阿尔法生物实验器材有限公司官网咨询我 —— 毕竟我们每天和这些实验耗材打交道,对不同细胞的适配性还是很熟的。
最后提醒一句:实验过程中做好记录(比如细胞浓度、孵育时间、染色时间),下次再做就能直接复用参数,不用再从头摸索啦~
苏州阿尔法生物实验器材有限公司成立于2008年,位于苏州园区生物纳米园(Biobay)A5幢301室。公司管理团队专注于科学仪器行业十四年,拥有专业的技术团队与完善的售后服务体系,目前已为300余家实验室提供优质产品和服务,涵盖各大高校、检测中心、科研机构、制药企业等13个群体。提供的实验室仪器主要包括振荡培养箱,恒温恒湿培养箱、二氧化碳培养箱、生化培养箱、霉菌培养箱、PCR仪,瑞宁移液器,生物反应器,发酵罐,超低温冰箱,液氮罐,高压灭菌器,超纯水机,天平,离心机,离心浓缩仪、研磨机、葡萄糖乳酸分析仪等。厂商企业授权包括知楚仪器、朗基、中科美菱,梅特勒,乐枫,搏旅、NEST、天根、奥盛在内的80个余厂家。



咨询热线
0512-62956104